Die Behandlungsarten von Lungenkrebs sind immer auf die Art der Tumore abgestimmt. Durch die vielen verschiedenen Formen und Stadien von Tumoren kommen daher unterschiedliche Therapien zum Einsatz. Aber auch der Patient selbst kann sich durch Ernährung oder einen Rauchstopp zusätzlich auf schwierige Behandlungen vorbereiten.
In folgender Reihenfolge können Sie die anschließenden Behandlungsmethoden im Detail lesen:
- Operation
- Chemotherapie
- Chemotherapie speziell
- Strahlentherapie
- Portsysteme
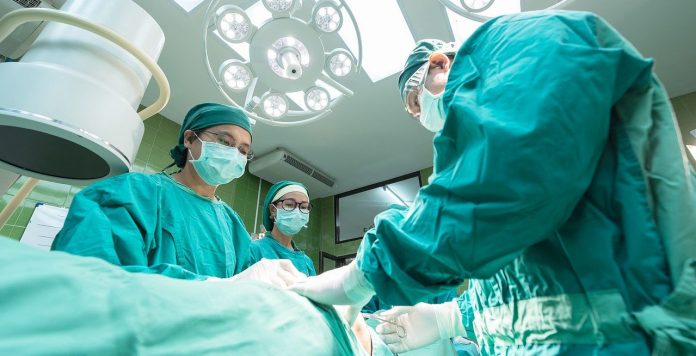
Operation
Bei der Operation des Lungenkrebses wird dieser gemeinsam mit dem befallenen Lungenanteil entfernt. Dieser große Eingriff bringt Risiken, unter der Voraussetzung der Operabilität, aber auch die Chance auf eine endgültige Heilung der Krankheit mit sich. Gelingt es, das bösartige Gewebe restlos zu entfernen, ist der Patient geheilt und der Krebs besiegt. In Einzelfällen kann eine Operation auch ohne Aussicht auf vollständige Entfernung des Tumors sinnvoll sein.
Bei nicht-kleinzelligen Karzinomen ist eine Operation die wirkungsvollste Therapieform und stellt somit die Methode der Wahl dar. Beim kleinzelligen Lungenkrebs wird dagegen in der Regel nicht operiert, da er besser auf eine Chemotherapie anspricht und vielfach schon Tochtergeschwüre (Metastasen) in andere Organe gestreut hat. Ob ein Tumor operabel ist hängt von vielen Faktoren ab. Voraussetzung ist sicherlich, dass sich das Lungenkarzinom noch nicht zu weit ausgebreitet hat. Auch die Lage des Tumors, das Alter des Patienten und die Lungenfunktion spielen bei der Entscheidung eine wichtige Rolle.
Röntgenaufnahmen und eine Computertomographie der Lunge geben Auskunft über die Lage und Größe des Tumors. Das Vorliegen von Metastasen bedeutet zumeist ein so weit fortgeschrittenes Krebsstadium, dass eine Operation keine Aussicht auf Erfolg hat. Ein Eingriff würde in diesem Fall den Patienten nur belasten und gefährden. Wenn Ihre Ärzte von einer Operation Abstand nehmen, geschieht dies nicht, um Ihnen eine Therapie vorzuenthalten, sondern um Sie vor Schaden und unnötigen Belastungen zu bewahren.
Optimale Vorbereitung senkt das Risiko
Eine Operation ist mehr, als das Herausschneiden eines Tumors. Besonders die unbedingt erforderliche Vollnarkose kann für einzelne Betroffene zu einer Gefahr werden. Daher müssen Patienten vor einem operativen Eingriff von einem Internisten und einem Anästhesisten (Narkosearzt) untersucht und für die Operation frei gegeben werden. Das ist keine Schikane, sondern dient der Sicherheit rund um die Operation.
So sollte besonders die Lungenfunktion zum Zeitpunkt der Operation optimal sein. Raucher müssen daher mindestens zwei Wochen vor der Operation mit dem Rauchen aufhören. Atemtherapeutische Maßnahmen können die Lungenfunktion verbessern. Natürlich muss auch das Herz mitspielen, Operationszeiten von zwei Stunden und mehr stellen eine merkliche Belastung für das Kreislaufsystem dar. Wird die Freigabe zum Eingriff verwehrt, kann ein vorübergehendes Problem der Grund sein. Es kann aber auch eine begleitende Erkrankung so ausgeprägt sein, dass die Operation nicht möglich ist.
So radikal wie nötig – so schonend wie möglich
Das Ziel des thoraxchirurgischen Eingriffes ist die vollständige Entfernung des Tumors und aller mitbefallenen Strukturen. Gleichzeitig wird versucht, möglichst viel von dem funktionstüchtigen Lungengewebe zu erhalten. Trotzdem muss ein ausreichender Sicherheitsabstand im gesunden Gebiet gewahrt werden. Die Anatomie der Lunge bedingt, dass immer ganze Segmente, häufiger ganze Lappen oder auch ganze Lungenflügel entnommen werden müssen. Als Lobektomie wird die Entfernung eines Lungenlappens bezeichnet. Sie stellt die klassische, dem malignen Tumor gerecht werdende Resektion dar.
Bei sehr großen Tumoren mit zentralem, Sitz und lappenüberschreitendem Wachstum, oder bei langstreckigem Tumorbefall des Hauptbronchus, kann eine Pneumektomie, die Entfernung eines ganzen Lungenflügels erforderlich sein. Dehnt sich der Tumor oder die entzündliche Begleitreaktion bis zum Rippenfell aus, muss auch dieses abgelöst werden. Keil- und Segmentresektionen sind kleinere Eingriffe, die meist bei der Entfernung von Metastasen angebracht sind. Da es nicht möglich ist, beide Lungenflügel zu entfernen – weil der Betroffene dann keine Lunge mehr hätte – sind Tumore, welche beide Seiten befallen haben üblicherweise nicht operabel.
Der Brustkorb wird von der Seite eröffnet
Um in den Thorax zu gelangen, wird ein Schnitt seitlich unter dem Schulterblatt angelegt, der zwischen zwei Rippen geführt wird. Oft werden die fünfte und sechste Rippe auseinandergespreizt und so der Zugang zur Brusthöhle ermöglicht. Die Operationsdauer beträgt 2-4 Stunden. Bei der Operation wird die gesunde Lunge durch den Narkosearzt beatmet, während der Thoraxchirurg die Lungengefäße und Bronchien des befallenen Lungenteils durchtrennt. So kann er den Lungenlappen bzw. den gesamten Lungenflügel entnehmen. Abschließend wird der Brustkorb mit Nähten verschlossen und Schläuche, sog. Drainagen werden in die Brusthöhle gelegt. Durch sie wird einerseits das Wundsekret abgeleitet, zum anderen wird über ein Saugsystem der natürliche Unterdruck im Thorax wieder hergestellt.
Eine Nachbestrahlung kann erforderlich sein
Je nach Größe und Art des Tumors kann nach einer erfolgreichen Operation eine Bestrahlung notwendig sein. Sie wird in der Regel ambulant durchgeführt. Durch die Strahlentherapie sollen möglicherweise verbliebene Tumorzellen abgetötet, oder zumindest zahlenmäßig reduziert werden. Die Strahlenbehandlung kommt aber nicht nur im Anschluss an eine Operation zum Einsatz. In Kombination mit einer Chemotherapie kann sie manche inoperablen Tumore so weit zu verkleinern, dass doch eine Operation möglich ist. Auch zur Nachbehandlung gehören eine rasche Mobilisation und Rehabilitation: Nach der Operation ist eine intensive Atemtherapie erforderlich. Sie trägt dazu bei, die Funktion der verbliebenen Lungenabschnitte zu optimieren.
Engmaschige Kontrolle hilft Rezidive früh zu erkennen
Durch regelmäßige Kontrolluntersuchungen soll ein neuerliches Auftreten des Tumors (Rezidiv) oder von Metastasen frühzeitig erkannt werden. In den ersten Jahren nach dem Eingriff ist die Wahrscheinlichkeit eines Rezidivs höher, als wenn jemand bereits viele Jahre rezidivfrei ist. Daher wird in dieser Zeit besonders engmaschig kontrolliert. Nach und nach werden die Nachsorgeintervalle größer, ganz aus den Augen möchten Sie Ihre Ärzte auch nach einem geheilten Lungenkrebs nicht lassen. Es ist wichtig, dass Sie als Patient diese Kontrollen wahrnehmen und mögliche Symptome und Veränderungen berichten. Zur Tumornachsorge gehören eine körperliche Untersuchung, Laborkontrollen, besonders der Tumormarker und Röntgenuntersuchungen.
Palliative Eingriffe bringen Lebensqualität
Nur durch eine thoraxchirurgische Operation ist es heute in den frühen Stadien des Lungenkrebses möglich, eine echte Heilung zu erzielen. Ist der Tumor inoperabel oder kann durch eine Operation nicht vollständig entfernt werden, wird zumeist eine Chemotherapie und / oder eine Strahlentherapie durchgeführt. Aber selbst in fortgeschrittenen Stadien kann oft in so genannten multimodalen Konzepten durch die Kombination aus Operation, Chemotherapie und Bestrahlung ein für den Patienten zufrieden stellendes Ergebnis ohne definitive Heilung erzielt werden. Die Abwägung, welcher Eingriff sinnvoll ist, orientiert sich in der palliativen Situation weniger am Tumor, als am Patienten: Erfolg in der Palliativmedizin ist, wenn es dem Patienten nach einer Maßnahme gut geht.
Chemotherapie
Das Wirkprinzip der Chemotherapie richtet sich in den meisten Fällen gegen Zellen in Teilung. Tumorzellen sind durch ihre extrem hohen Teilungsraten besonders empfindlich, doch auch gesunde Gewebe werden in Mitleidenschaft gezogen. Chemotherapie ist eine Belastung für den gesamten Organismus, aber auch eine Chance den Krebs in die Knie zu zwingen.
Neue Chemotherapiekombinationen haben auch beim Lungenkrebs zu einer Verlängerung der Überlebenszeiten geführt.
Krebszellen wachsen ungehemmt. Sie teilen und vermehren sich viel rascher, als die meisten gesunden Gewebe. Eine Zellteilung folgt der nächsten und das Krebsgewebe wuchert durch den Körper. Bei diesem rücksichtslosen Wachstum geht Quantität vor Qualität: die Krebszellen verlieren viele ihrer ursprünglichen Funktionen. Je weniger sie mit jener Zelltype, von der sie ursprünglich ausgegangen sind gemeinsam haben, desto entarteter und bösartiger werden sie. Dieses Verhalten macht verwundbar, denn die Tumorzellen verlieren oft auch protektive Mechanismen, die sie vor äußeren Einflüssen schützen. Zudem sind Zellen im Stadium der Teilung besonders empfindlich. Die meisten Chemotherapeutika greifen Zellen daher während der Teilung an.
Chemotherapeutika sind Zellgifte
Die Chemotherapie setzt an der erhöhten Sensibilität der Krebszellen an: die eingesetzten Wirkstoffe sind genauer betrachtet Gifte, die bei einem gesunden Menschen nur Schaden anrichten würden. Denn die Wirkung erstreckt sich auf den gesamten Körper, sie ist nicht oder nur teilweise selektiv für Krebszellen. Auch für den Krebskranken stellt die Chemotherapie eine enorme Belastung dar. Allerdings hat die Behandlung ein klares Ziel: wenn es gelingt, die Krebszellen zu vernichten, ist der Patient geheilt. Durch die Therapie in Mitleidenschaft gezogene Gewebe erholen sich aber wieder.
Es gilt also die Wirkstoffe so zu kombinieren, dass ein maximaler Effekt an den Krebszellen, bei gleichzeitig minimalem Schaden an gesunden Zellen erzielt wird. Auch unter den gesunden Zellen sind jene am stärksten betroffen, welche sich am häufigsten teilen. Dazu gehören alle rasch wachsenden Epithelien, allen voran die Darmschleimhaut und die Haarwurzeln. Aber auch die Blutkörperchen werden geschädigt. Weil ein Mangel an weißen Blutkörperchen anfällig gegenüber Infektionen macht, sind vor jedem neuen Chemotherapiezyklus Kontrollen des Blutbildes erforderlich. Ist das weiße Blutbild ‚schlecht’ muss die Chemotherapie in der Regel um eine Woche verschoben werden. Eine Verminderung der roten Blutkörperchen kann eine bei Krebskranken häufige Müdigkeit und Schwäche verstärken.
In dieser Situation kann die Gabe einer Blutkonserve erforderlich werden. Neue molekularbiologische Techniken haben es ermöglicht, die natürlichen Wachstumsfaktoren für rote und weiße Blutkörperchen nachzubauen. Sie kommen heute als Injektionen bei Krebskranken mit Blutbildveränderungen häufig zum Einsatz.
Was Sie rund um die Chemotherapie wissen sollten
Chemotherapie ist nicht gleich Chemotherapie. Im Gegenteil, die Wahl der Wirkstoffe und vor allem ihre Dosierung wird für jeden Patienten individuell getroffen. Die meisten Präparate werden in die Venen verabreicht. Diese Infusionen sind keine Standardprodukte, sondern werden ebenfalls für jeden Patienten vom Apotheker frisch zubereitet. Die Dosierung wird ganz exakt eingestellt. Grundlage dafür ist die Körperoberfläche, sie wird vom Arzt aus Gewicht, Größe und Geschlecht errechnet. Daher werden Chemotherapiepatienten regelmäßig gewogen. Zur Chemotherapie im eigentlichen Sinn kommt oft eine beachtliche Anzahl weiterer Medikamente, vor allem die Prämedikation. Sie dient der Vorbereitung auf die Therapie und enthält Wirkstoffe, die die Verträglichkeit verbessern. Die Entwicklung neuer hochwirksamer Medikamente gegen Übelkeit und Erbrechen haben viele Chemotherapieschemata erst möglich gemacht, da diese sonst nicht zumutbar wären.
Ihre Verlässlichkeit als Patient spielt eine große Rolle für den erfolgreichen Ablauf der Therapie. Beachten Sie die vereinbarten Termine genau, denn die Präparate müssen in einem exakten Zeitplan verabreicht werden. Zudem sind die frisch für Sie hergestellten Infusionen sehr teuer und nur kurz haltbar. Ihre Mitarbeit ist auch rund um die Infusion gefragt. Viele Patienten entscheiden sich vor Therapiebeginn für einen dauerhaften zentralen Venenzugang (Port). Dieser ist nicht nur für Arzt und Patient komfortabel, weil er jede Menge Stiche erspart, sondern stellt vor allem einen sicheren Zugang dar.
Das ist wichtig, weil viele der Infusionen lokal sehr aggressiv sind. Sie greifen die Venenwände an und können, wenn es zu einem Austritt aus der Vene kommt schwere Gewebsschäden verursachen. Wenn Sie bemerken, dass eine Infusion schmerzt, oder eine Schwellung im Bereich der Infusionskanüle auftritt, zögern Sie keinesfalls sich zu melden! In diesem Fall muss die Infusion sofort gestoppt und eine neue Kanüle gesetzt werden.
Ein Wort zur Ernährung
Krebserkrankungen sind zehrend. Das Wachstum des Tumors verschlingt ungeheure Energie und braucht die Fett- und Vitaminreserven des Körpers rücksichtslos auf. Die Folge ist eine starke Gewichtsabnahme bei vielen Krebskranken. Sie kann bis zur Kachexie, der Auszehrung bis auf die Knochen reichen. Es ist daher besonders wichtig, auf eine hochwertige und vitaminreiche Ernährung zu achten. Daher darf es auch ein wenig mehr sein. Ein Rat für den Krebskranken lautet: „Essen Sie, solange es Ihnen schmeckt und vergessen Sie eventuelle frühere Diäten. Essen Sie gut, essen sie ausgewogen und verzichten Sie auf nichts.“
Das gilt auch während einer Chemotherapie, allerdings mit der Einschränkung, dass Sie von übermäßigem Alkoholkonsum Abstand nehmen sollten. Gegen ein Glas Bier oder Wein wird jedoch in der Regel nichts einzuwenden sein. Bedenken Sie, dass Essen und Trinken ein wesentlicher Bestandteil Ihrer Lebensqualität sind und üben Sie keinen unnötigen Verzicht. Sollten Sie etwas besonders gerne und viel essen und nicht sicher sein, ob es schädlich für Sie ist, zögern Sie nicht, Ihren Arzt darüber zu fragen.
Für viele Menschen mit Lungenkrebs kommen Tage, an denen jede Lust auf Essen und Trinken vergangen sind. Tage, an denen Übelkeit und Appetitlosigkeit dominieren. Dennoch brauchen Betroffene gerade in dieser Zeit Kraft und Vitamine. Hier können verschiedene kräftigende Nahrungsergänzungsmittel helfen. Diese Produkte sind speziell für Krebskranke entwickelt worden und sind das genaue Gegenteil der heute so modernen ‚light’ Produkte. Diese Milchshakes, Puddings oder Cremen sind in verschiedenen Geschmacksrichtungen erhältlich und bieten neben vielen wertvollen Kalorien und Proteinen auch Vitamine und Mineralstoffe. Ihr Arzt hilft Ihnen, diese Produkte zu beantragen, die Kosten werden – bei entsprechendem Untergewicht – von der Krankenkasse übernommen.
Häufige Nebenwirkungen der Chemotherapie
Die Chemotherapie wirkt im gesamten Körper, auch gesunde Gewebe werden in Mitleidenschaft gezogen. Besonders häufig kommt es zum Haarausfall. Diese medizinisch harmlose Erscheinung kann seelisch sehr belastend werden. Daher steht jedem Patienten für die Dauer des Haarausfalls eine professionell angepasste Perücke zu. Erfreulicherweise kommen die Haare nach Beendigung der Therapie meistens wieder zurück. Zudem tritt der Haarausfall nicht bei allen Menschen, nicht bei allen Wirkstoffen und auch nicht immer bereits nach dem ersten Zyklus auf. Eine andere häufige Nebenwirkung ist Übelkeit.
Wie bereits erwähnt, stehen heute sehr starke Medikamente gegen Übelkeit und vor allem Erbrechen zur Verfügung. Da die Darmschleimhaut besonders von der Behandlung mit Zytostatika geschädigt wird, treten gelegentlich auch Durchfälle auf. Eine weitere Nebenwirkung sind Veränderungen des Blutbildes, durch das Zugrundegehen roter und weißer Blutkörperchen und ihre Vorstufen im Knochenmark. Deswegen wird das Blutbild von Betroffenen regelmäßig kontrolliert. In seltenen Fällen kommt es auch vor, dass ein Medikament im Sinne einer echten Allergie nicht vertragen wird. Dann kommt es vor allem zu Hautausschlägen und Juckreiz während und nach der Therapie.
Chemotherapie wird individuell angepasst
Unter dem Begriff Chemotherapie wird eine Vielzahl verschiedener Wirkstoffe zusammengefasst. Mit zum Teil ganz unterschiedlichen Mechanismen zerstören sie Tumorzellen oder hemmen deren Wachstum. Nicht jeder Krebstyp spricht auf Chemotherapeutika an. Beim Lungenkrebs sind kleinzellige Karzinome empfindlicher, als andere Gewebetypen. In der Praxis haben sich Kombinationen mehrerer Wirkstoffe besonders bewährt, diese werden als Chemotherapieprotokolle zusammengefasst.
Chemotherapeutika, auch Zytostatika genannt, sind Zellgifte. Sie schädigen alle Gewebe des Körpers, bevorzugt aber einzelne Krebszellinien. Heute sind mehr als 30 zur Therapie verschiedenster Krebserkrankungen geeignete Wirkstoffe bekannt und zugelassen. Manche Krebserkrankungen sind durch ihre Einführung heilbar geworden und haben an Schrecken verloren. Beispiele dafür sind manche Leukämieformen oder der Hodenkrebs, bei denen ausgezeichnete Therapieerfolge erzielt werden. Gegen andere Krebse, wie das Pankreaskarzinom oder viele Gehirntumoren gibt es nach wie vor kaum Medikamente. Beim Lungenkrebs ist die Situation gespalten. Fest steht heute, dass sowohl kleinzellige, als auch nicht-kleinzellige Bronchuskarzinome mit einer Chemotherapie behandelt werden können. Die Ansprechraten sind bei den kleinzelligen Formen deutlich besser, was nicht bedeuten soll, dass eine Chemotherapie etwa bei einem Adenokarzinom vergebens sei.
Vielfältige Chemotherapieprotokolle
Ist die Entscheidung für eine Chemotherapie getroffen, muss eine exakte Planung erfolgen. Die Therapie beginnt in diesem Fall als ‚first-line’ – die Erstlinientherapie, sie kann mehrere Zyklen und Pausen umfassen. Wenn die Erstlinientherapie nicht anspricht, kann ein Umstieg auf ein alternatives Schema, die ‚second-line’ mit geänderter Wirkstoffzusammensetzung zum Tragen kommen. In der Folge sind noch weitere Linien möglich, mit denen der Tumor wieder und wieder zurückgeworfen werden soll. Voraussetzung für einen Therapieerfolg ist neben der Wahl eines geeigneten Wirkstoffes oder einer Kombination auch die Dosierung und der zeitliche Ablauf der Therapie. Als Patient werden sie in ein striktes Protokoll eingegliedert, welches auf den Tag genaue Behandlungen vorsieht. Es ist wichtig, dass sie diese Termine wahrnehmen – Ihre Medikamente sind keine Fertigprodukte. Sie werden vom Apotheker individuell hergestellt und sind nur kurz haltbar. Chemotherapie ist sehr teuer, alle Beteiligten bemühen sich sehr, eine optimale Wirkung für Sie zu erzielen. Ihre Verlässlichkeit spielt eine große Rolle für den Erfolg!
Kleinzelliges Bronchuskarzinom
Diese Krebsart ist durch sehr schnelles und aggressives Wachstum, aber auch ein gutes Ansprechen auf Zytostatika gekennzeichnet. Wird diese Erkrankung bei einem Patienten erkannt, stehen die Überlebenschancen ohne Chemotherapie schlecht. Je nach Ausdehnung des Tumors muss von einer durchschnittlichen Überlebenszeit zwischen zwei und vier Monaten ausgegangen werden. Eine Chemotherapie kann das erwartete Überleben auf sieben bis zwanzig Monate erhöhen. Bei diesen Zahlen muss beachtet werden, dass es sich um Durchschnitte handelt und einzelne Patienten durchaus länger, aber auch kürzer leben können.
Für die first-line Therapie des kleinzelligen Lungenkrebses werden vor allem platinhältige Zytostatika verwendet. Cis- und Carboplatin sind lange bekannte Chemotherapeutika, die durch den Einsatz starker Medikamente gegen die häufig von ihnen ausgelöste Übelkeit starke Verbreitung gewonnen haben. Zu den Nebenwirkungen dieser Wirkstoffe gehören Störungen der Nierenfunktion und des Blutbildes. Diese müssen im Verlauf der Therapie engmaschig kontrolliert werden. Platinhältige Zytostatika werden in dreiwöchigen Abständen mit hohen Flüssigkeitsmengen und zumeist mit dem Wirkstoff Etoposid kombiniert verabreicht. In der second-line Chemotherapie hat sich Topotecan bewährt. Dieses Zytostatikum zeichnet sich vor allem durch seine gute Wirksamkeit gegen Hirnmetastasen aus. Es kann, im Gegensatz zu anderen Präparaten in das Gehirn eindringen. Alternativ kommt eine als EPICO bezeichnete Kombination dreier Zytostatika in Frage.
Nicht kleinzelliges Bronchuskarzinom
Auch bei diesen Gewebetypen ist die Wirksamkeit der Chemotherapie bewiesen. Allerdings sind derzeit keine Standardprotokolle für die Therapie etabliert, sodass viele Faktoren über die endgültige Auswahl der Wirkstoffe entscheiden. Für die Erstlinientherapie wird zumeist Cisplatin in Kombination mit einem weiteren Zytostatikum, zumeist Gemcitabine, Docetaxel, Vinorelbine oder Paclitaxel verwendet. Alle vier Kombinationspartner sind gut verträgliche Präparate. Bei Vinorelbine ist allerdings die starke lokale Gewebereizung zu beachten – Venen leiden sehr unter diesem Wirkstoff.
Daher muss peinlich auf einen gut liegenden Venenzugang und reichlich Spülung nach der Therapie geachtet werden. Paclitaxel und Docetaxel sind interessanterweise Wirkstoffe, die aus einem Pflanzengift abgeleitet sind: Das Gift der Eibe, einem beliebten Ziergewächs ist strukturell mit diesen Zytostatika verwandt. Für nachfolgende Therapielinien kann zwischen den Kombinationspartnern gewechselt werden. Darüber hinaus gibt es seltene Spezialchemotherapeutika – manche von ihnen können auch geschluckt werden – die in besonderen Situationen gebraucht werden. Zudem konnte gezeigt werden, dass eine adjuvante, also einer Operation nachfolgende Chemotherapie das Gesamtüberleben verbessern kann.
Chemotherapie speziell
Unter dem Begriff Chemotherapie wird eine Vielzahl verschiedener Wirkstoffe zusammengefasst. Mit zum Teil ganz unterschiedlichen Mechanismen zerstören sie Tumorzellen oder hemmen deren Wachstum. Nicht jeder Krebstyp spricht auf Chemotherapeutika an. Beim Lungenkrebs sind kleinzellige Karzinome empfindlicher, als andere Gewebetypen. In der Praxis haben sich Kombinationen mehrerer Wirkstoffe besonders bewährt, diese werden als komplexe Chemotherapieprotokolle zusammengefasst.
Chemotherapeutika, auch Zytostatika genannt, sind Zellgifte. Sie schädigen alle Gewebe des Körpers, bevorzugt aber einzelne Krebszellinien. Heute sind mehr als 30 zur Therapie verschiedenster Krebserkrankungen geeignete Wirkstoffe bekannt und zugelassen. Manche Krebserkrankungen sind durch ihre Einführung heilbar geworden und haben an Schrecken verloren.
Beispiele dafür sind einzelne Leukämieformen oder der Hodenkrebs, bei denen ausgezeichnete Therapieerfolge erzielt werden. Gegen andere Krebse, wie das Pankreaskarzinom oder viele Gehirntumoren gibt es nach wie vor kaum Medikamente. Beim Lungenkrebs ist die Situation gespalten. Fest steht heute, dass sowohl kleinzellige, als auch nicht-kleinzellige Bronchuskarzinome mit einer Chemotherapie behandelt werden können. Die Ansprechraten sind bei den kleinzelligen Formen deutlich besser, was nicht bedeuten soll, dass eine Chemotherapie etwa bei einem Adenokarzinom vergebens sei.
Vielfältige Chemotherapieprotokolle
Ist die Entscheidung für eine Chemotherapie getroffen, muss eine exakte Planung erfolgen. Die Therapie beginnt in diesem Fall als ‚first-line‘ – die Erstlinientherapie, sie kann mehrere Zyklen und Pausen umfassen. Wenn die Erstlinientherapie nicht anspricht, oder nach erfolgreicher Therapie später ein Rezidiv auftaucht, kann ein Umstieg auf ein alternatives Schema, die ‚second-line‘ mit geänderter Wirkstoffzusammensetzung zum Tragen kommen.
In der Folge sind noch weitere Linien möglich, mit denen der Tumor wieder und wieder zurückgeworfen werden soll. Voraussetzung für einen Therapieerfolg ist neben der Wahl eines geeigneten Wirkstoffes oder einer Kombination auch die Dosierung und der zeitliche Ablauf der Therapie. Als Patient werden sie in ein striktes Protokoll eingegliedert, welches auf den Tag genaue Behandlungen vorsieht. Es ist wichtig, dass sie diese Termine wahrnehmen – Ihre Medikamente sind keine Fertigprodukte. Sie werden vom Apotheker individuell hergestellt und sind nur kurz haltbar. Chemotherapie ist sehr teuer, alle Beteiligten bemühen sich sehr, eine optimale Wirkung für Sie zu erzielen. Ihre Verlässlichkeit spielt eine große Rolle für den Erfolg!
Kleinzelliges Bronchuskarzinom
Diese Krebsart ist durch sehr schnelles und aggressives Wachstum, aber auch ein gutes Ansprechen auf Zytostatika gekennzeichnet. Wird die Erkrankung bei einem Patienten erkannt, stehen die Überlebenschancen ohne Chemotherapie schlecht. Je nach Ausdehnung des Tumors muss von einer durchschnittlichen Überlebenszeit zwischen zwei und vier Monaten ausgegangen werden.
Eine Chemotherapie kann das erwartete Überleben auf sieben bis zwanzig Monate erhöhen. Bei diesen Zahlen muss beachtet werden, dass es sich um Durchschnitte handelt und einzelne Patienten durchaus länger, aber auch kürzer leben können. Für die first-line Therapie des kleinzelligen Lungenkrebses werden vor allem platinhältige Zytostatika verwendet. Cis- und Carboplatin sind lange bekannte Chemotherapeutika, die durch den Einsatz starker Medikamente gegen die häufig von ihnen ausgelöste Übelkeit starke Verbreitung gewonnen haben. Zu den Nebenwirkungen dieser Präparate gehören Störungen der Nierenfunktion und des Blutbildes.
Diese müssen im Verlauf der Therapie engmaschig kontrolliert werden. Platinhältige Zytostatika werden in dreiwöchigen Abständen mit hohen Flüssigkeitsmengen und zumeist mit dem Wirkstoff Etoposid kombiniert verabreicht.
In der second-line Chemotherapie hat sich Topotecan bewährt. Dieses Zytostatikum zeichnet sich vor allem durch seine gute Wirksamkeit gegen Hirnmetastasen aus. Es kann, im Gegensatz zu anderen Präparaten in das Gehirn eindringen. Alternativ kommt eine als EPICO bezeichnete Kombination dreier Zytostatika in Frage.
Therapieschemata im Detail
- Cisplatin – Etoposid: Eine Standardchemotherapie beim kleinzelligen Bronchuskarzinom, welche in 21 tägigem Rhythmus für 4 bis 6 Zyklen verabreicht wird. Ein Zyklus beinhaltet am ersten Tag die Infusion beider Wirkstoffe, danach drei oder fünf Tage nur Etoposid. Die Gabe von Cisplatin setzt eine zumindest ausreichende Nierenfunktion voraus. Um die nierenschädigende Wirkung dieses Medikaments gering zu halten, bekommen Patienten unter diesem Schema sehr viel Flüssigkeit und ein entwässerndes Mittel. Daher dauern die Infusionen verhältnismäßig lange. Eine weitere Voraussetzung ist, dass Patienten, welche Cisplatin erhalten, keine vorbestehenden Hörschäden haben, da auch das Gehör durch die Therapie beeinträchtigt werden kann. Etoposid (Handelsname Vepesid®) ist ein gut verträgliches Zytostatikum.
- Carboplatin – Etoposid: Bei diesem Protokoll wird Cisplatin durch den Wirkstoff Carboplatin ersetzt. Carboplatin ist weniger Nierentoxisch, gilt aber als potentiell nebenwirkungsreicher: Das Blutbild, hierbei besonders die weißen Blutkörperchen, leidet unter dieser Therapie. Protokolle mit Carboplatin werden gerne bei Patienten mit eingeschränkter Nierenfunktion angewandt. Subjektiv empfinden Patienten Therapieprotokolle mit Carboplatin angenehmer, als mit Cisplatin, welches stärkere Übelkeit auslöst.
- Cisplatin – Irinotecan: Bei diesem Chemotherapieprotokoll kommt es zu geringerer Beeinträchtigung des weißen Blutbildes, als bei Cisplatin – Etoposid. Allerdings beklagen etwa 20 % der Patienten zum Teil schwere Durchfälle. Diese können sowohl sofort, als auch einige Tage verzögert auftreten. Irinotecan wird häufig mit seinem Handelsnamen Campto® bezeichnet.
- Topotecan: Dieses Zytostatikum (Handelsname Hycamtin®) wird in der Second line Therapie eingesetzt und gilt in dieser Indikation als erste Wahl. Ein Zyklus dauert eine ganze Woche und beinhaltet fünf Wirkstoffinfusionen. Als eines der ganz wenigen liquorgängigen, also die Gehirnflüssigkeit erreichenden Chemotherapeutika entfaltet Topotecan auch gegen Hirnmetastasen seine Wirkung. Insgesamt können mit Topotecan bei etwa 30 % der Patienten (Teil-)Remissionen erzielt werden.
- EPICO: Dieses Schema wird nach den beteiligten Komponenten Epirubicin, Cyclophosphamid und Vincristin (Handelsname Oncovin®) benannt. Deren Kombination gilt heute als Alternative zu Topotecan in der Second Line Therapie. Es ist mit vergleichsweise häufigeren Störungen des weißen Blutbildes zu rechnen. Auffallend an diesem Protokoll ist die leuchtend rote Farbe des Wirkstoffs Epirubicin. Diese Infusionsbeutel werden Sie sofort erkennen.
- Irinotecan: Eine Monotherapie mit Irinotecan kann als Third Line Therapie, also nach zwei vorangegangenen Protokollen angewandt werden. Die Problematik der mitunter schweren Durchfälle bleibt auch in dieser Situation aufrecht.
Nicht kleinzelliges Bronchuskarzinom
Auch bei diesen Gewebetypen ist die Wirksamkeit der Chemotherapie bewiesen. Allerdings sind derzeit keine Standardprotokolle für die Therapie etabliert, sodass viele Faktoren über die endgültige Auswahl der Wirkstoffe entscheiden. Für die Erstlinientherapie wird zumeist Cisplatin in Kombination mit einem weiteren Zytostatikum, zumeist Gemcitabine, Docetaxel, Vinorelbine oder Paclitaxel verwendet. Alle vier Kombinationspartner sind gut verträgliche Präparate.
Bei Vinorelbine ist allerdings die starke lokale Gewebereizung zu beachten – Venen leiden sehr unter diesem Wirkstoff. Daher muss peinlich auf einen gut liegenden Venenzugang und reichlich Spülung nach der Therapie geachtet werden. Paclitaxel und Docetaxel sind interessanterweise Wirkstoffe, die aus einem Pflanzengift abgeleitet sind: Das Gift der Eibe, einem beliebten Ziergewächs ist strukturell mit diesen Zytostatika verwandt. Für nachfolgende Therapielinien kann zwischen den Kombinationspartnern gewechselt werden. Darüber hinaus gibt es seltene Spezialchemotherapeutika – manche von ihnen können auch geschluckt werden – die in besonderen Situationen gebraucht werden. Zudem konnte gezeigt werden, dass eine adjuvante, also einer Operation nachfolgende Chemotherapie das Gesamtüberleben verbessern kann.
Therapieschemata im Detail
- Cisplatin – Vinorelbine: Eine Standardchemotherapie beim nicht-kleinzelligen Bronchuskarzinom, welche in 21 tägigem Rhythmus für 4 bis 6 Zyklen verabreicht wird. Ein Zyklus beinhaltet am ersten Tag die Infusion beider Wirkstoffe, am achten Tag eine Dosis Vinorelbine. Die Gabe von Cisplatin setzt eine zumindest ausreichende Nierenfunktion voraus. Um die nierenschädigende Wirkung dieses Medikaments gering zu halten, bekommen Patienten unter diesem Schema sehr viel Flüssigkeit und ein entwässerndes Mittel. Daher dauern die Infusionen verhältnismäßig lange. Vinorelbine (Handelsname Navelbine®) ist ein stark venenschädigendes Zytostatikum, es sollte bevorzugt über ein Portsystem verabreicht werden. Als Alternative zur Infusion kann Vinorelbine am achten Tag auch geschluckt werden. Das wegen entsprechend der Handelsnamen kurz als CIS-NAV Schema bezeichnete Protokoll gilt als gut verträglich und kommt häufig zum Einsatz.
- Carboplatin – Vinorelbine: Bei diesem Protokoll wird Cisplatin – wie beim kleinzelligen Bronchuskarzinom beschrieben – durch den Wirkstoff Carboplatin ersetzt. Carboplatin ist weniger Nierentoxisch, gilt aber als potentiell nebenwirkungsreicher: Das Blutbild, hierbei besonders die weißen Blutkörperchen, leidet unter dieser Therapie. Protokolle mit Carboplatin werden gerne bei Patienten mit eingeschränkter Nierenfunktion angewandt. Subjektiv empfinden Patienten Therapieprotokolle mit Carboplatin angenehmer, als mit Cisplatin, welches stärkere Übelkeit auslöst.
- Cisplatin – Gemcitabine: Therapieschemata mit dem Wirkstoff Gemcitabine sind im Gegensatz zu praktisch allen anderen Protokollen mit vier- statt dreiwöchigen Zyklen aufgebaut. Eine häufige Nebenwirkung dieser Therapie ist die Thrombopenie, der Abfall der Blutplättchen. Die subjektive Verträglichkeit der Kombination ist gut.
- Docetaxel oder Paclitaxel: Docetaxel und Paclitaxel sind Wirkstoffe aus der Eibe. Sie kommen sowohl als Monotherapie, also alleine, als auch in Kombination mit Cisplatin zur Anwendung. Ein wichtiges Einsatzgebiet dieser Zytostatika sind kurative Therapieeinsätze, also wenn eine vollständige Heilung des Krebses, wie sie nur in frühen Stadien möglich ist, angestrebt wird. Das bedeutet, dass Docetaxel und Paclitaxel besonders in Kombination mit einer Operation verabreicht werden. Sie sind aber auch für die Second Line Therapie gut geeignet.
- Pemetrexed: Ein neuer, sehr teurer Wirkstoff, welcher unter dem Handelsnamen Alimta® in der Second Line Therapie eingesetzt wird. Seine geringen Nebenwirkungen machen ihn besonders für Menschen, bei denen es während der ersten Zyklen zu besonders starken unerwünschten Effekten gekommen ist, geeignet.
- Erlotinib: Ist ebenfalls neu als Second Line Therapeutikum eingeführt worden ausgesprochen teuer. Erlotinib (Handelsname Tarceva®) blockiert einen Wachstumsfaktor, der auf Tumorzellen vermehrt gebildet wird und verbessert so die Überlebensrate in der Second Line Situation. Neueste Forschungen lassen einen Vorteil bei Adenokarzinomen erwarten. Eine charakteristische Nebenwirkung ist die Hautrötung (Exanthem, Rush), welche bei mehr, als der Hälfte aller Patienten auftritt.
Strahlentherapie
Die Bestrahlung ist neben der Operation und der Chemotherapie das dritte Standbein der Krebstherapie. Ihr großer Vorteil ist, dass Tumoren oder Metastasen ganz gezielt bestrahlt und die anderen Körperregionen geschont werden können. Neue diagnostische Techniken erlauben eine sehr enge Begrenzung des therapierten Areals. Mit der Brachytherapie können Bestrahlungen direkt im Bronchialsystem durchgeführt werden.
Als Strahlentherapie bezeichnet man die Behandlung eines Tumors mit energiereichen Röntgenstrahlen, oder seltener radioaktiven Isotopen. Das Wirkprinzip ist unspezifisch: Zellen im betroffenen Gebiet (Strahlenfenster) werden soweit geschädigt, dass sie absterben. Auch gesundes Gewebe im Strahlenbereich nimmt Schaden. Allerdings kommt hier, ebenso wie bei der Chemotherapie, ein wichtiges Prinzip zur Anwendung: Manche Krebszellen sind deutlich empfindlicher, als ihre Umgebung gegen die schädlichen Strahlen. Gesunde Zellen erholen sich wesentlich schneller und ertragen selbst eine neuerliche Strahlendosis am Folgetag.
Nicht so die vorgeschädigten Lungenkrebszellen: sie werden mit jeder Sitzung stärker in Mitleidenschaft gezogen, sodass sie nach mehreren Therapieeinheiten gänzlich absterben. Eine optimale Strahlendosis kann alle oder zumindest den Großteil der bösartigen Zellen vernichten, aber die mitbestrahlten Organe weitgehend intakt lassen. Nicht alle Gewebetypen des Lungenkrebses sprechen gleich gut auf Strahlung an. Besonders die kleinzelligen Karzinome können mit der Strahlentherapie gut angegriffen werden. In den letzten Jahren hat sich gezeigt, dass die Bestrahlung gewisser Lungenkrebspatienten eine wichtige ergänzende Behandlungsmaßnahme ist.
Manche Medikamente und Chemotherapeutika können die Empfindlichkeit von Tumoren gegen die Bestrahlung deutlich steigern und eignen sich gut zur Kombination, als so genannte Radiochemotherapie. Durch diese Symbiose ist es gelungen, die Langzeitergebnisse der gesamten Behandlung zu verbessern.
Enge Strahlenfenster sind entscheidend
Da die Strahlung naturgemäß auch gesunde Zellen schädigt, muss der bestrahlte Bereich so klein wie möglich gehalten werden. Am besten, es würde nur der Tumor angestrahlt. Moderne bildgebende Techniken helfen dem Strahlentherapeuten das Bestrahlungsfenster präzise einzustellen. So werden die Nebenwirkungen stark begrenzt. Wenn ein Lungenkrebs bestrahlt wird, werden am Brustkorb genaue Markierungen mit einem haltbaren Filzstift angebracht. Die Behandlung kann dann an mehreren aufeinander folgenden Tagen immer wieder im exakt gleichen Gebiet durchgeführt werden.
In der Praxis werden Patienten dazu vor Therapiebeginn dem Strahlentherapeuten zugewiesen. Dieser plant anhand der computertomographischen Voruntersuchungen die Therapie in Hinblick auf Lokalisation, Dosis und Dauer. Die Patienten erhalten dann in der Regel ambulante Termine d.h. sie müssen nicht im Krankenhaus übernachten, sondern kommen von zu Hause zur Behandlung. Diese selbst dauert nur wenige Minuten und ist nicht schmerzhaft. Zum Schutz des Behandlungsteams vor der Strahlung müssen Sie allein im Therapieraum bleiben. Die Verbindung zu Ihnen wird während der gesamten Zeit über Kameras und Gegensprechanlagen gehalten.
Strahlentherapie als OP – Nachsorge
Bei vielen Lungenkrebsfällen kann eine Operation Hoffnung auf eine endgültige Heilung der Krankheit bedeuten. Manchmal gelingt es aber nicht, alles Krebsgewebe operativ zu entfernen, etwa weil die Gefahr besteht, wichtige Gefäße zu verletzen oder weil sich bereits kleine Tumorausläufer gebildet haben, die nicht erreichbar sind. Wenn das der Fall ist, oder wenn sich in der anschließenden pathologischen Untersuchung des entfernten Lungenabschnitts zeigt, dass der Tumor nicht im Gesunden entfernbar war, kann eine anschließende Bestrahlung sinnvoll sein. Das gleiche gilt in allen unsicheren Fällen, also wenn nicht ausgeschlossen werden kann, dass doch unbemerkt Krebsgewebespuren verblieben sind. Nicht nur in der Operationsnachsorge hat die Strahlentherapie einen festen Stellenwert.
Wenn ein Tumor zu groß oder zu ausgedehnt ist, um gleich operiert zu werden, kann er durch die Bestrahlung häufig soweit zurückgedrängt werden, dass doch operiert werden kann. Dieses Prinzip wird als Down-Staging, also Herunterstufen bezeichnet und dürfte nach neueren Erkenntnissen die Überlebenschancen von Betroffenen verbessern. Es muss allerdings eingeräumt werden, dass die Heilungschancen eines durch Bestrahlung verkleinerten Tumors nicht so günstig sind, als wäre dieser von Haus aus so klein gewesen.
Bestrahlung als OP – Alternative
Gründe für eine Inoperabiltät gibt es viele: ein zu weit ausgedehnter Tumor, ein zu schlechter Gesundheitszustand des Patienten, oder eine ausgedehnte Metastasierung können eine Operation aussichtslos oder gefährlich machen. Mit der Strahlentherapie gibt es eine verhältnismäßig schonende Methode, den Krebszellen doch Widerstand zu leisten. Gerade in der palliativen, also nicht mehr auf Heilung, sondern auf Symptomlinderung ausgerichteten Situation ist die Strahlentherapie wichtig. Sie kann den Krebs stark zurückdrängen und dem Patienten einen deutlichen Zugewinn an Lebenszeit und vor allem Lebensqualität bringen.
Metastasen sind ein wichtiges Anwendungsgebiet
Metastasen können überall im Körper von Lungenkrebspatienten vorkommen. Nur selten sind sie operativ entfernbar. Eine Strahlentherapie kann hingegen ganz gezielt gegen einzelne Tochtergeschwülste selbst in fortgeschrittenen Stadien erfolgen. Die Bestrahlung von Metastasen hat beim Lungenkrebs besonders in einem Organ große Bedeutung: dem Gehirn. Dabei spielen drei Faktoren mit: zum ersten sind Gehirnmetastasen relativ häufig.
Daher wird bei jedem Lungenkrebspatienten bereits bei Diagnosestellung eine Magnetresonanztomographie des Kopfes durchgeführt. Dank wirkungsvollerer Krebstherapie leben Patienten heute länger, so steigt die Wahrscheinlichkeit, dass in späteren Krankheitsabschnitten Hirnmetastasen entstehen. Zweitens hat das Gehirn eine natürliche Barriere gegen Medikamente, die Blut-Hirn-Schranke. Diese Schutzfunktion führt dazu, dass viele Chemotherapeutika im Gehirn nicht wirken, weil sie dort gar nicht ankommen, sondern zuvor ‚herausgefiltert’ werden. Der dritte Punkt ist ein positiver: das menschliche Gehirn ist ein empfindliches Organ. Gehirnzellen sterben, wenn sie drei Minuten ohne Durchblutung vom Sauerstoff abgeschnitten sind. Überraschenderweise ertragen die Gehirnzellen alle Arten von Strahlung außerordentlich gut.
Das liegt nicht zuletzt daran, dass die Bestrahlung – wie die Chemotherapie – in erster Linie Zellen schädigt, die sich teilen und vermehren. Unsere Gehirnzellen teilen sich nicht, jede von ihnen ist so alt, wie wir selbst. So ist die Bestrahlung bei Vorliegen von Hirnmetastasen die Therapie der Wahl. Wenn Patienten primär eine Chemotherapie erhalten und der Krebs nicht mehr nachweisbar ist, wird häufig eine vorbeugende Bestrahlung des Kopfes durchgeführt.
Nebenwirkungen der Strahlentherapie
Die Nebenwirkungen der Bestrahlung hängen davon ab, welcher Körperteil mit welcher Strahlendosis behandelt wird. Häufige Nebenwirkungen sind Appetitlosigkeit, Müdigkeit, ein trockener Hals und Schluckbeschwerden. Nachdem die Dosierung der Strahlung heute sehr exakt vorgenommen wird, sind akute Hautschäden, wie sie früher im Sinne von Strahlenverbrennungen vorkamen, kein Thema mehr.
Trotzdem leidet die Haut und kann einige Zeit nach der Bestrahlung dünner und empfindlicher werden. Gelegentlich treten im Bestrahlungsfeld leichte Verfärbungen der Haut, sowie Verhärtungen des Unterhautfettgewebes auf. Bei Patienten, deren Schädel bestrahlt wird, kann es zu Kopfschmerzen, Hautveränderungen, Müdigkeit, Übelkeit und Erbrechen, Haarausfall oder Gedächtnis- und Denkstörungen kommen. Die meisten dieser Nebenwirkungen verschwinden nach einiger Zeit wieder.
Da es bei der Bestrahlung des Thorax unvermeidbar ist, einen Teil des gesunden Lungengewebes mit zu bestrahlen, können Wochen bis Monate nach der Behandlung entzündliche Veränderungen auftreten. Sie verlaufen zumeist asymptomatisch, sind jedoch im Röntgenbild sichtbar. Später können aus diesen Entzündungen Vernarbungen des Lungengewebes, die als Fibrosen bezeichnet werden hervorgehen. Die Symptome der Lungenfibrose können Hustenreiz und eine Verminderung der Atemkapazität sein.
Die Brachytherapie wirkt ganz lokal
Grundsätzlich kann jede Krebszelle mit Strahlung getötet werden. Ob das in der Praxis möglich ist, liegt ausschließlich daran, ob das bösartige Gewebe erreicht werden kann, ohne gesunde Organe zu schädigen. Besonders die perkutanen, also durch die Haut gerichteten Strahlen müssen einige gesunde Gewebeschichten passieren, um an den Krebs zu kommen. Würde die Strahlenquelle direkt an den Tumor heran geführt werden, könnten viel höhere Energien abgegeben werden.
Diesen Ansatz nützt die Brachytherapie. Das Wort ‚brachys’ leitet sich aus dem Altgriechischen ab und bedeutet ‚nahe’. Genau das trifft für diese Methode, sie wird auch als Afterloading bezeichnet, zu: Im Rahmen einer Bronchoskopie wird eine Strahlenquelle direkt an das Karzinom heran geführt. Es werden kurze, energiereiche Strahlen mit geringer Eindringtiefe eingesetzt. Sie zeigen sehr viel Wirkung in ihrer unmittelbaren Umgebung, dringen aber kaum weiter, als einige Millimeter in die Lunge ein. Der Nachteil der Methode liegt in ihrem hohen Aufwand und der Belastung für den Patienten durch die Bronchoskopie und Anästhesie.
Portsysteme
Portsysteme sind unter die Haut eingepflanzte Kammern mit Anschluss an eine große Körpervene. Sie ermöglichen eine zuverlässige und schonende Verabreichung von Infusionen, allen voran der Chemotherapie. Der Einbau ist ein kleiner chirurgischer Eingriff in Narkose, der Patienten vor einer Chemotherapie empfohlen wird. Ein Port braucht auch Pflege: er muss regelmäßig gespült und strikt sauber gehalten werden.
Krebspatienten müssen viele Stiche erdulden. Manchmal täglich folgende Blutabnahmen, immer wieder neue Infusionskanülen oder zentrale Zugänge (ZVK). Nicht immer machen die Venen dabei mit. Im Gegenteil, oft haben Betroffene bereits von Haus aus ‚schlechte Venen’. Wenn nicht, tut eine Chemotherapie das Übrige um die peripheren Gefäße zu schädigen. Selbst Menschen mit vormals zahlreichen und dicken Venen bekommen die Wirkung zu spüren: die Adern werden dünn, brüchig und empfindlich. Das wiederkehrende Stechen kann rasch für Patient und Arzt zur Tortur werden. Ein Port kann vieles davon verhindern.
Der Einbau ist eine kurze Operation
Ports werden von verschiedenen Herstellern angeboten. Ihr Aufbau ist stets ähnlich, sie bestehen aus einer Portkammer und einem angeschlossenen Venenkatheter, der wie ein Schlauch Verbindung zu einer großen zentralen Vene hat. Das ganze System wird knapp unter die Haut gelegt, sodass es gut tastbar ist, aber nicht durchtritt. Die Portkammer mit Anschluss zur Vene kann durch die Haut mit einer gebogenen Nadel angestochen werden, da sie von einer dünnen, aber widerstandsfähigen Membran bedeckt ist. Einmal angestochen, kann die Nadel bis zu eine Woche verwendet werden.
Der Entschluss zum Einpflanzen des Ports sollte frühzeitig, möglichst noch vor Beginn einer Chemotherapie getroffen werden. Der Einbau selbst wird in Allgemeinnarkose oder seltener in lokaler Betäubung durchgeführt, der Anschluss erfolgt an die Hauptvene der Schulter oder des Halses, seltener in der Leiste. Dazu wird das Gefäß mit einem kurzen Schnitt frei gelegt, der Katheter eingeführt und in die Hohlvene, die größte Vene des menschlichen Körpers vorgeschoben. Die korrekte Lage wird anschließend im Röntgen, gegebenenfalls mit Kontrastmittel überprüft. Üblicherweise gelingt der Einbau problemlos, Komplikationen und Nebenwirkungen sind selten.
Es kann unter Umständen zum Durchstoßen eines Gefäßes mit Blutung, aber auch zum Gegenteil, der Thrombusbildung kommen. Ebenso können ein Pneumothorax oder Verletzungen der Lymph- und Nervenbahnen im Operationsgebiet vorkommen. Selten treten Herzrhythmusstörungen während des Einbaus auf. Wie bei jeder Operation sind Wundinfektionen möglich.
Portsysteme brauchen Pflege
Sie sind für Ihren Port mitverantwortlich! Achten Sie darauf, dass er auch während therapiefreier Intervalle mindestens alle 3 Monate gespült wird. Portsysteme können relativ leicht durch geronnenes Blut verstopft werden und sollten nach Verwendung vom Arzt mit einer stark verdünnten Heparinlösung gespült werden. Insbesondere nach einer Chemotherapie muss der Katheter gereinigt werden. Vermeiden Sie Manipulationen am Port.
Das System ist zwar stabil eingebaut, darf aber von außen nicht stark verschoben werden. Bei Verletzungen, z.B. Stürze oder Schläge auf das Portgebiet sollten Sie die korrekte Funktion überprüfen lassen. Der Port ist ein eingebauter Fremdkörper und als solcher ein mögliches Zuhause für Bakterien. Achten Sie darauf, dass die Portnadel mindestens wöchentlich gewechselt wird. Wenn Sie in tagesklinischer Betreuung stehen und mit dem angestochenen Port nach Hause gehen, denken Sie an größte Sauberkeit!